Elektrische stroom.


- Manuel Gort
- vrijdag 29 januari 2016
- 190 Views
Leestijd
Gemiddeld genomen tijd dat iemand dit artikel leest.
Kosten
Dit zijn ongeveer de kosten dat wij hebben betaald.
Gereedschap
Niveau
Dit is een richtlijn aan de moeilijkheid van de klus.
Elektrische stroom komt voort uit de kleinste, onzichtbare deeltjes waar alle stoffen uit zijn opgebouwd. Elke grondstof (element) bestaat uit atomen.
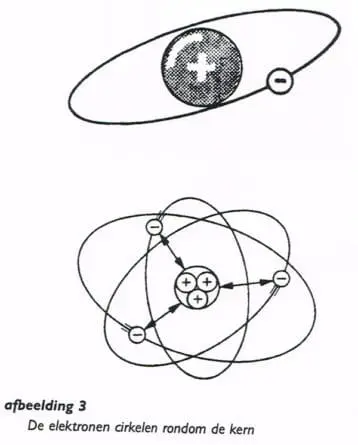
Een atoom bestaat uit een kern, met daar omheen draaiend één of meer elektronen (afbeelding. 3).
De kern is positief geladen, de elektronen zijn negatief geladen.
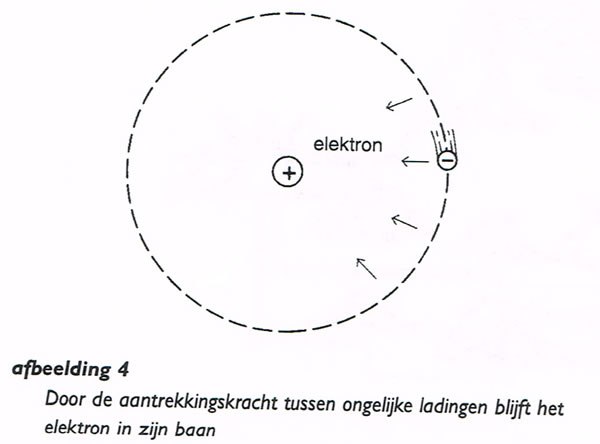
Omdat een positieve lading en een negatieve lading elkaar aantrekken, blijven de elektronen in hun baan om de kern (afbeelding. 4).
In afbeelding 5 zie je een koperatoom. De elektronen cirkelen in verschillende ringen om de kern.
De buitenste ring telt slechts één elektron.
Dit elektron is gemakkelijk uit zijn baan te krijgen en kan dus gemakkelijk naar een ander koperatoom overspringen.
Elektronen die gemakkelijk uit hun baan zijn te krijgen, heten vrije elektronen.


Geleiders en isolatoren.
Stoffen die vrije elektronen bezitten, zijn in staat elektrische stroom te geleiden.
Zij worden daarom geleiders genoemd.
De vrije elektronen kunnen gemakkelijk overspringen en dat zorgt voor een goede geleiding van de elektrische stroom.
Stoffen die geen vrije elektronen bezitten, zijn niet in staat een elektrische stroom te geleiden.
Zij worden daarom isolatoren genoemd.
De elektronen zitten min of meer vast in het atoom en kunnen dus niet overspringen naar andere atomen.
Positieve en negatieve lading.
Onder normale omstandigheden is de positieve lading van een atoom (in de kern) gelijk aan de negatieve lading van dat atoom (de elektronen).
Zo’n atoom is neutraal.
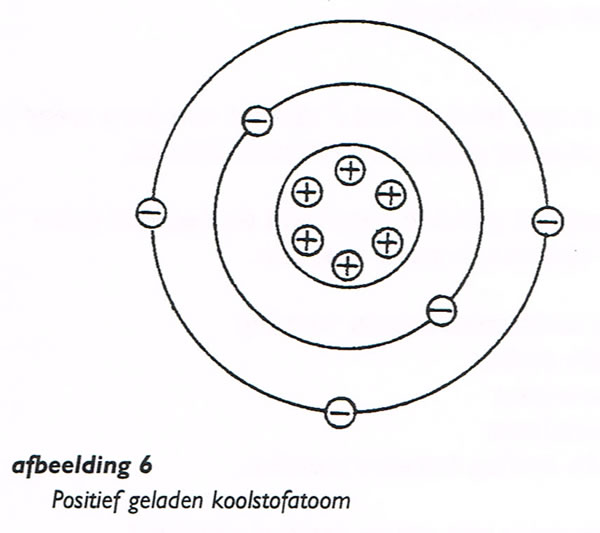
Wanneer één of meer elektronen uit hun baan verwijderd zijn, is het atoom positief geladen
(afbeelding. 6). De ontbrekende elektronen zijn immers negatief geladen.
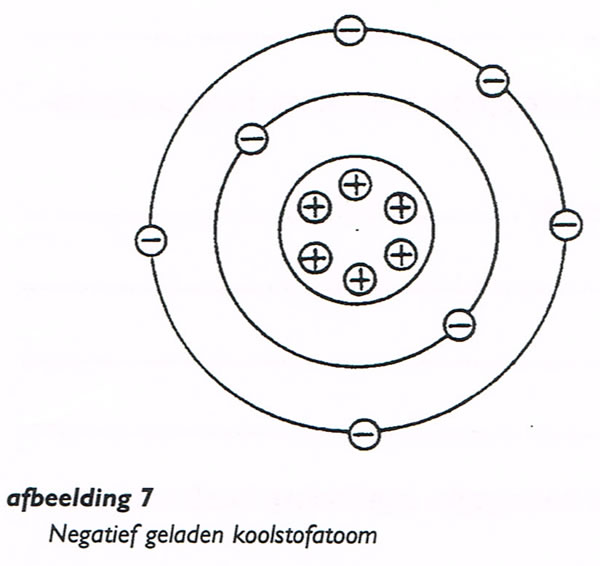
Het is ook mogelijk om aan een atoom één of meer elektronen toe te voegen in de buitenste ring.
Zo’n atoom is dan negatief geladen (afb. 7).
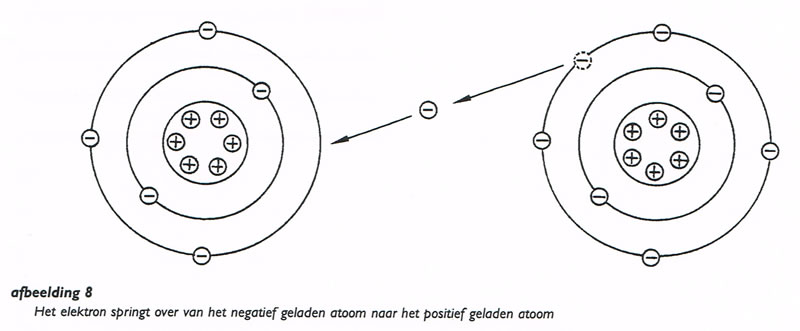
Als een negatief en een positief geladen atoom zich naast elkaar bevinden, zal het overtollige elektron van het negatief geladen atoom worden aangetrokken door het positief geladen atoom (afbeelding. 8).
Wanneer dit elektron zijn plaats heeft ingenomen in het positief geladen atoom, bestaat er tussen beide atomen geen ladingsverschil meer.
Beide atomen zijn dan weer neutraal.